ПРИНСТОН, Нью-Джерси – Сегодня Bristol-Myers Squibb Company обнародовали дополнительные, промежуточные данные второго этапа клинических испытаний новой схемы лечения гепатита С у пациентов с генотипом 1 вируса. Согласно этим данным, 12- и 24-недельные тройные схемы, включающие противовирусные препараты прямого действия – даклатасвир, асунапревир и BMS-791325, позволили достигнуть высоких показателей устойчивого вирусологического ответа (УВО) – до 94% у ранее нелеченых пациентов с генотипом 1 на 4 – 36 неделях посттерапевтического периода, в зависимости от группы пациентов.
Эти результаты позволяют продолжить разработку этой новой схемы, не содержащей интерферон, рибавирин либо ритонавир, в ходе третьего этапа исследования, запланированного на конец 2013 года.
План исследования и результаты
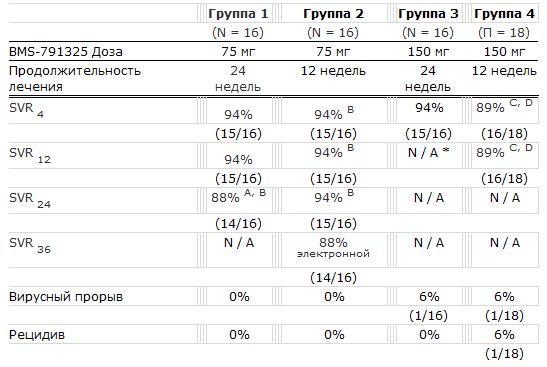
Этот открытый второй этап исследования, состоящий из двух частей, был разработан для оценки безопасности и противовирусной активности изучаемой схемы лечения гепатита С, состоящей из даклатасвира, асунапревира и BMS-791325 для применения у пациентов, прежде не получавших лечения и имеющих генотипы 1a или 1b ВГС. Первичной целью стало достижение уровня вирусной нагрузки ниже нижнего предела количественного определения (lower limit of quantitation, LLOQ) РНК ВГС <25 IU/мл на 12 неделе после окончания лечения (УВО12). Первая часть исследования оценивала следующую схему: даклатасвир 60 мг один раз в день, асунапревир 200 мг два раза в день, BMS-791325 75 мг два раза в день в течение 24 или 12 недель (группы №1 и №2 соответственно). Вторая же часть исследования оценивала такие же схемы, но с дозой BMS-791325 150 мг дважды в день (группы №3 – 24 недели и №4 – 12 недель).
Промежуточные результаты первой части исследования ранее были представлены на ежегодной встрече Американской ассоциации по изучению заболеваний печени (American Association for the Study of the Liver) в ноябре 2012 г. Исследование было расширено в ноябре 2012 г. за счет добавления 8 новых групп лечения – для оценки эффективности тройной схемы лечения у нелеченых пациентов с генотипом 4 и пациентов без ответа на терапию с генотипом 1. Результаты по этим группам еще не обнародованы. Вирусологический ответ 100% (28/28) пациентов в группах №1 и №2 (24- и 12-недельное лечение, доза BMS-791325 75 мг) достигло УВО24 и/или УВО36. Во время лечения не было зафиксировано вирусного прорыва, а после лечения рецидив не наблюдался ни у кого из пациентов. 91% (31/34) пациентов в группах №3 и №4 (24- и 12-недельное лечение, доза BMS-791325 150 мг) достигло УВО4. У 3 из 34 пациентов наблюдалась вирусологическая неудача (неэффективность лечения) во время или после лечения.
Безопасность во время лечения Во время лечения не наблюдалось случаев смерти или отказа от продолжения лечения вследствие непереносимости или возникновения неблагоприятных побочных эффектов от BMS-791325. Наблюдалось два случая тяжелых побочных эффектов – в группах №3 и №2. Первый случай – церебральная вазоконстрикция вследствие интенсификации терапии ПЭГ-интерфероном-α и рибавирином (было предпринято в ответ на вирусный прорыв), что стало причиной прекращения лечения. Известно, что церебральная вазоконстрикция является побочным эффектом интерферона-α. Второй случай, обострение мочекаменной болезни у пациента из группы №2, по мнению исследователей не был связан с изучаемыми препаратами. Большинство зафиксированных побочных эффектов были легкой или средней степени тяжести. Наиболее распространенными (≥10% всех побочных эффектов) у пациентов всех групп лечения были головная боль (27,3%, 18/66), слабость (16,7%, 11/66), диарея (16,7%, 11/66) и тошнота (13,6%, 9/66). В ходе исследования не наблюдалось значительного (3 – 4 степени) повышения уровня печеночных ферментов (АСТ, АЛТ) или билирубина. Один случай выраженной головной боли был купирован к концу первой недели, что позволило продолжить лечение. Также был один случай выраженных изменений лабораторных показателей; один случай лимфопении зафиксирован в группе №2 у пациента с сопутствующим гриппом. Выраженность остальных побочных эффектов была оценена как слабая или умеренная (1 – 2 степень).
Перевод для www.hv-info.ru Katya Shabunevich